Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Element chimic
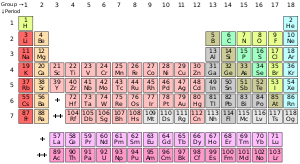
Prin noțiunea de element chimic se înțelege o specie de atomi identici, adică de atomi având același număr de protoni în nucleul atomului, respectiv un număr identic de electroni în învelișul electronic al atomului. Definiția nu se referă la numărul de neutroni din nucleu, ceea ce înseamnă că noțiunea de element chimic include toți izotopii acelui element chimic.
Savantul rus Dimitri I. Mendeleev a descoperit legea periodicității elementelor chimice și a conceput o reprezentare grafică a interdependenței sofisticate a tuturor speciilor unice de atomi, tabelul periodic al elementelor.
Sunt identificate 118 elemente, dintre care primele 94 apar natural pe Pământ, restul fiind elemente sintetice.[1] Există 80 de elemente care au cel puțin un izotop stabil și 38 care au exclusiv radionuclizi, care se descompun în timp în alte elemente. Fierul este cel mai abundent element (ca masă) care formează Pământul, în timp ce oxigenul este cel mai frecvent element din crusta Pământului.
Elementele chimice constituie toată materia obișnuită a universului. Cu toate acestea, observațiile astronomice sugerează că materia observabilă obișnuită reprezintă doar aproximativ 15% din materia din univers: restul este materia întunecată; compoziția acestei materii este necunoscută, dar nu este compusă din elemente chimice. Cele două elemente mai ușoare, hidrogen și heliu, au fost formate în cea mai mare parte în Big Bang și sunt cele mai comune elemente din univers. Următoarele trei elemente (litiu, beriliu și bor) au fost formate în mare parte prin spalarea cu radiație cosmică (nucleosinteză) și, prin urmare, sunt mai rare decât elementele mai grele. Formarea elementelor de la 6 până la 26 de protoni a apărut și continuă să apară în stelele secvenței principale prin nucleosinteză stelară. Abundența mare de oxigen, siliciu și fier pe Pământ reflectă producția lor obișnuită în astfel de stele. Elementele cu mai mult de 26 de protoni se formează prin nucleosinteza în supernove, care, atunci când explodează, aruncă aceste elemente ca rămășițe departe în spațiu, unde pot ajunge încorporate în planete atunci când sunt formate.
Termenul "element" este utilizat pentru atomii cu un număr dat de protoni (indiferent dacă sunt sau nu ioni sau legați chimic, de exemplu, hidrogenul din apă), precum și pentru o substanță chimică pură care constă dintr-un singur element (de exemplu, hidrogen gazos). Pentru al doilea sens, au fost sugerați termenii "substanță elementară" și "substanță simplă", dar nu s-au bucurat de multă acceptare în literatura chimică engleză, în timp ce în alte limbi echivalentul lor este utilizat pe scară largă. Un singur element poate forma mai multe substanțe care diferă în structura lor; ele sunt numite alotropi ai elementului.[2]
Atunci când diferite elemente sunt combinate chimic, cu atomii deținuți împreună prin legături chimice, ele formează compuși chimici. Numai o mică parte a elementelor se găsește nemodificată ca minerale relativ pure. Printre elementele native mai frecvente se numără cuprul, argintul, aurul, carbonul (sub formă de cărbune, grafit sau diamante) și sulful. Toate, cu excepția câtorva dintre cele mai inerte elemente, cum ar fi gazele nobile și metalele nobile]], se găsesc de obicei pe Pământ în formă combinată chimic, ca și compuși chimici. În timp ce aproximativ 32 de elemente chimice apar pe Pământ în forme necombinate native, cele mai multe dintre acestea apar ca amestecuri. De exemplu, aerul atmosferic este în primul rând un amestec de azot, oxigen și argon, iar elementele solide native apar în aliaje, cum ar fi cele de fier și nichel.
Istoria descoperirii și utilizării elementelor a început cu societăți primitive umane care au găsit elemente native precum carbon, sulf, cupru și aur. Civilizațiile ulterioare au extras din minereurile lor, prin topire, cupru, staniu, plumb și fier, prin utilizarea cărbunelui. Alchimiștii și chimiștii au identificat ulterior mult mai multe; aproape toate elementele naturale au fost cunoscute până în 1900.
Proprietățile elementelor chimice sunt rezumate în tabelul periodic al elementelor, care organizează elementele prin creșterea numărului atomic pe rânduri ("perioadele") în care coloanele ("grupurile") au proprietăți fizice și chimice recurente ("periodice"). Cu excepția elementelor radioactive instabile cu timpi de înjumătățire scurți, toate elementele sunt disponibile din punct de vedere industrial, majoritatea în grade scăzute de impurități.[2]
- ^ „Elemente chimice”. SetThings.com. . Accesat în .
- ^ a b Sfetcu, Nicolae (). Materia: Solide, Lichide, Gaze, Plasma - Fenomenologie. MultiMedia Publishing. ISBN 978-606-9016-12-1.
Previous Page Next Page


